阿尔茨海默病突破性新药仑卡奈单抗全球III期临床结果重磅发布
美国时间2022年11月29日-12月2日在旧金山举办的第15届阿尔茨海默病临床试验会议(CTAD)开幕首日,万众瞩目的淀粉样蛋白(Aβ)靶向治疗药物Lecanemab(仑卡奈单抗,BAN2401)研究团队报告了全球Clarity AD研究Ⅲ期临床结果。
会议由来自东京大学的Takeshi Iwatsubo教授主持,卫材临床研究副总裁Michael Irizarry开场介绍了研究背景和设计。Clarity AD是一项为期18个月的全球、安慰剂、双盲、平行、对照、开放期延续的III期临床试验,旨在评估仑卡奈单抗治疗早期阿尔茨海默病(AD)患者的有效性和安全性。该研究共纳入1795例经Aß-PET或脑脊液确认脑内存在AD病理改变,MMSE评分22-30分的早期AD(包括AD源性的轻度认知功能障碍和轻度AD)患者,以1:1的比例随机接受仑卡奈单抗(10 mg/kg静脉注射,每两周一次)或安慰剂治疗(图1)。
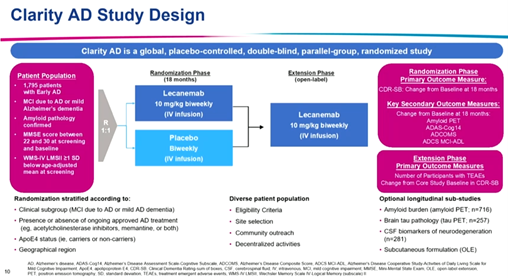
图1 Clarity AD试验设计
耶鲁医学院Christopher van Dyck教授介绍了Clarity AD的topline疗效结果(图2-图5),治疗18个月后,主要研究终点临床痴呆评定量表总评分(CDR-SB)较基线变化为-0.45,达到显著统计学差异(P<0.001),仑卡奈单抗治疗组与安慰剂组相比认知衰退幅度减缓27%(图2)。CDR-SB评分从患者记忆、定向、判断和解决问题的能力、社区活动、家庭和嗜好以及个人照顾六方面进行综合性评估。关键次要终点中,阿尔茨海默病评定量表-认知(ADAS-Cog)14较基线变化为-1.44,达到显著统计学差异(P<0.001),治疗组衰退幅度与安慰剂组相比减缓了26%。阿尔茨海默病综合评分(ADCOMS)较基线变化为-0.005,达到显著统计学差异(P<0.001),治疗组衰退幅度与安慰剂组相比减缓了24%。轻度认知障碍日常生活活动量表(ADCS-MCI-ADL)治疗组衰退幅度与安慰剂组相比减缓了37%。另外,分期亚组(MCI-AD或轻度AD)、是否携带ApoE4基因、是否同时使用其他获批治疗AD的药物或地区差异(北美、亚洲、欧洲) 的患者均显示CDR-SB、ADAS-Cog14和ADCS-MCI-ADL的结果一致。这些临床指标的结果提示,仑卡奈单抗能显著延缓早期AD患者认知、日常和社会能力的减退,延缓疾病进展,降低照料负担。
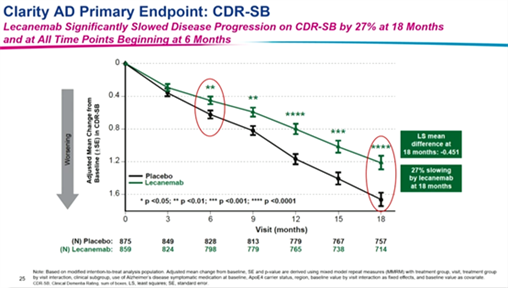
图2 仑卡奈单抗治疗组与安慰剂组患者CDR-SB评分
同时根据CDR总分评估,仑卡奈单抗治疗转入下一阶段疾病的风险降低31%(HR: 0.69)。(图3)基于CDR-SB斜率分析显示,如仑卡奈单抗持续治疗至25.5月,临床衰退将与安慰剂治疗18月时相当,证实其可延缓疾病进展达7.5个月。
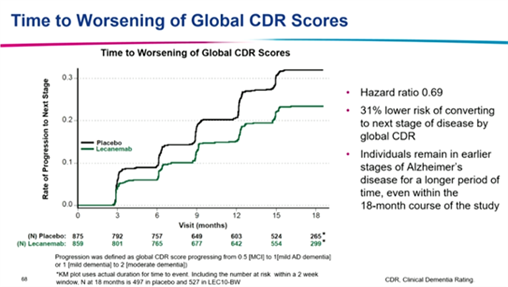
图3 仑卡奈单抗治疗对疾病进展的CDR总分评分风险影响
作为一种人源性抗Aβ原纤维的单克隆IgG1抗体,仑卡奈单抗可通过小胶质细胞靶向清除毒性Aβ聚集体如可溶性原纤维和寡聚体,延缓AD患者的神经退变和认知能力的下降。会议上公布了仑卡奈单抗治疗后降低脑脊液内Aβ水平的结果。3月时,Aβ降低了59.1 centiloid。仑卡奈单抗治疗18个月后,平均淀粉样蛋白PET为22.99 Centiloids,低于淀粉样蛋白的阳性阈值(30 Centiloids)(图4)。
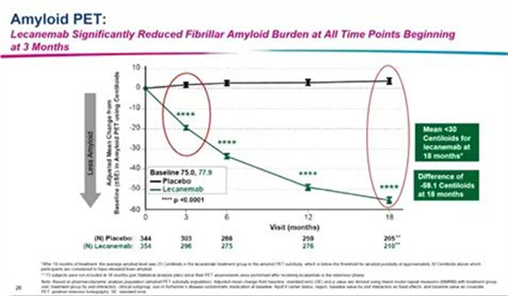
图4 仑卡奈单抗治疗组与安慰剂组脑脊液内Aβ水平的变化

图5 Clarity AD疗效总结
来自美国巴罗神经学研究所的Marwan Sabbagh教授详细介绍了安全性方面数据,仑卡奈单抗治疗中最常见的不良事件是输液反应,仑卡奈单抗治疗组26.4%的患者出现轻度至中度的输液反应。临床上备受关注的淀粉样蛋白相关影像学异常-渗出/水肿(ARIA-E)ARIA-E在仑卡奈单抗治疗组发生率为12.6%,安慰剂组为1.7%。ARIA-出血(H)在仑卡奈单抗治疗组发生率为17.3%,安慰剂组为9.0%。在研究期间,仑卡奈单抗组和安慰剂组中患者死亡率分别为0.7%和0.8%。无药物治疗相关死亡。(图6)

图6 Clarity AD安全性数据
华盛顿大学Randall J. Bateman教授发布了对于其他生物学指标,仑卡奈单抗也有很好的效果。如脑脊液磷酸化Tau蛋白(P-tau)、神经纤维缠结(NFTs)、神经纤维丝轻链(NfL)均有显著的降低。
总之,从认知、日常生活能力、疾病进展、与健康相关的生活质量、照护者的负担和生物标记物等多项指标表明,经仑卡奈单抗治疗可能为患者、护理人员和社会均带来益处。未来将更加明确Aß靶向治疗早期AD的方向和策略,同时促进向早期诊疗模式转变,以延缓疾病早期阶段的进展。
Takeshi lwatsubo教授表示,该项研究今日在顶级杂志New England Journal of Medicine已发布(图7)。目前美国FDA已接受了该药物生物制品许可申请(BLA),并授予优先审评资格,预计在2023年1月6日前做出决定。

图7 Clarity AD 新英格兰医学杂志发表
卫材中国总裁冯艳辉女士表示:
我们十分激动地见证了AD领域的里程碑,Clarity AD临床研究成果将有机会彻底改变AD的治疗现状。仑卡奈单抗可以有效延缓疾病进展,改善AD患者及家属的生活质量,减轻社会的公共负担,我们十分期待仑卡奈单抗在美国FDA的批复。卫材中国也会在第一时间将仑卡奈单抗引入中国,造福中国患者。作为AD领域的先行者,卫材将持续在全球打造AD生态圈,从预防、诊断、治疗、护理等方面助力AD医生、患者及家属,提供更多的医疗解决方案。